> Proteine der Familie der Interferone (IFN) 
Interferon (IFN) wurde erstmals 1957 von Alick Isaacs und Jean Lindenmann im Rahmen ihrer ersten Studien über virale Interferenzen entdeckt. Im Laufe der Jahre wurden verschiedene Studien über IFN durchgeführt, in denen seine antivirale Aktivität untersucht wurde. Erst 1980 konnte IFN in großem Maßstab für Forschungszwecke hergestellt werden, wobei die bahnbrechende rekombinante DNA-Technologie eingesetzt wurde. Es wurde entdeckt, dass IFN-Proteine neben ihrer inhärenten antiviralen Aktivität auch eine antitumorale und immunmodulatorische Funktion haben, worauf hin sie als eine Untergruppe der Zytokine eingestuft werden.
Die IFN-Proteinfamilie wird nach ihrem jeweiligen Rezeptor in drei Typen unterteilt: Typ I, Typ II und Typ III, die jeweils an unterschiedlichen Orten in der Zelle produziert werden. IFN-α und IFN-β sind die bekanntesten Vertreter der Typ-I-IFNs und werden hauptsächlich durch Pathogenese-assoziierte molekulare Muster (PAMPs) produziert. PAMPs werden durch Stimulation von Toll-like-Rezeptoren (TLR) oder zytoplasmatischen Mustererkennungsrezeptoren auf der Zellmembran ausgelöst. Bei den IFN vom Typ II gibt es nur einen Typ, IFN-γ, der von einer Vielzahl von Zellen des Immunsystems produziert wird. Dazu gehören angeborene lymphoidähnliche Zellpopulationen wie angeborene Lymphozyten (ILC) und natürliche Killerzellen (NK) sowie adaptive Immunzellen, bestehend aus T-Helferzellen 1 (Th1) und zytotoxischen T-Lymphozyten CD8 (CTL). Typ-III-IFNs werden hauptsächlich von Epithelzellen in nicht-hämatopoetischen Zellen produziert, wobei Viren die Expression von Typ-III-Interferon in verschiedenen Zelltypen vermitteln können. Seit der Entdeckung dieser IFNs im Jahr 2003 ist der genaue Mechanismus ihrer Produktion jedoch noch unbekannt und Gegenstand verschiedener wissenschaftlicher Studien.
Die entsprechenden Signalwege der drei IFN-Typen sind ebenfalls unterschiedlich, da sie jeweils an unterschiedlichen Anordnungen von heterodimeren Rezeptorkomplexen binden. Die intrazelluläre Signalübertragung erfolgt über den Janus-Kinase-Signalübertragungsweg und wirkt als Aktivator der Transkription (JAK/STAT).
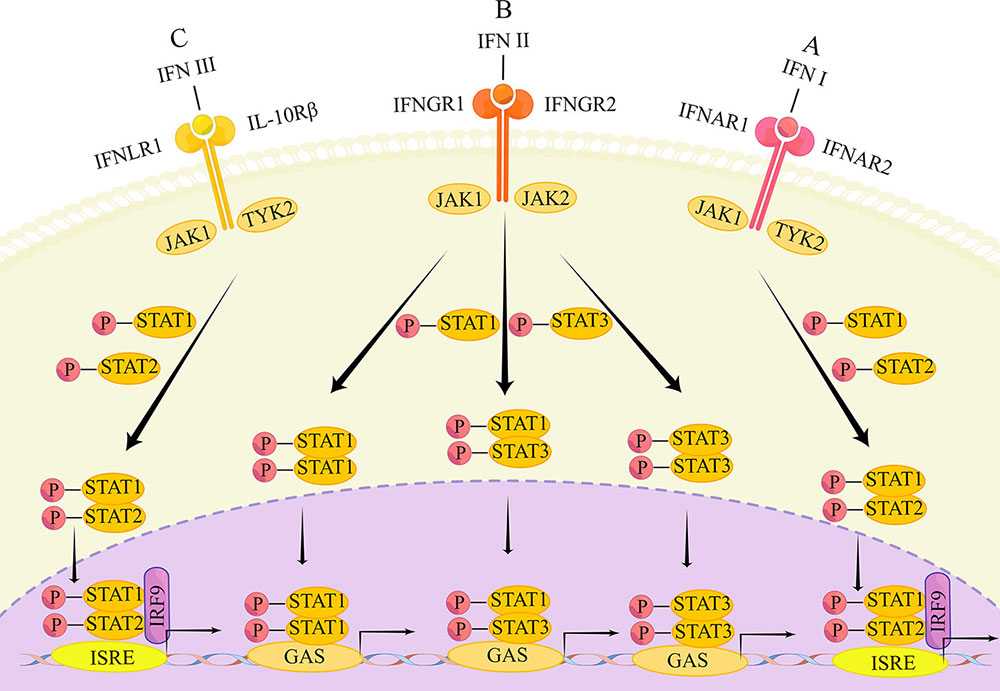
The main transduction pathways of the IFN signaling
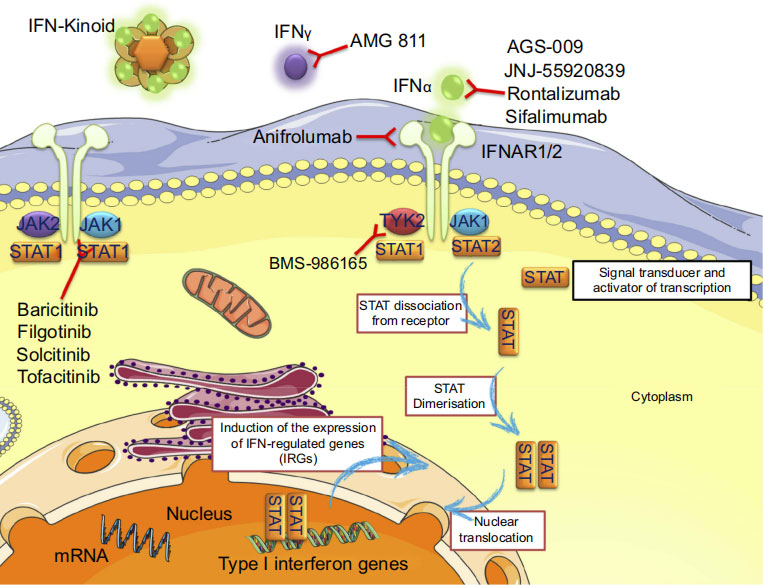
Mechanism of action of a drug targeting IFN (Anifrolumab)
Aufgrund der weitreichenden Auswirkungen der IFN-Regulationswege wird IFN häufig mit dem Fortschreiten von Tumorerkrankungen in Verbindung gebracht. In-vitro-Studien haben gezeigt, dass IFN das Wachstum von Tumorzellen hemmen kann, indem es den Zellkreislauf hochreguliert und gleichzeitig eine Apoptose auslöst, wobei es sich an Apoptose-induzierende Liganden bindet, die mit Tumornekrosefaktoren in Verbindung stehen. In-vivo-Studien haben jedoch gezeigt, dass die Zerstörung des Typ-I- oder Typ-II-Interferon-Signalweges die Tumorentstehung und -progression beschleunigt.
Die Korrelation zwischen sowohl Typ-I- als auch Typ-II-IFN-Reaktionen und onkogenen Wirkungen hat gezeigt, dass IFN ein wichtiger Weg zur Erforschung von Arzneimittelresistenz bei Krebs ist. Dies wurde an den verbliebenen Tumorzellen nach einer Krebstherapie beobachtet, die intakte oder teilweise intakte IFN-Signalwege aufwiesen. Infolgedessen entwickelt sich eine Resistenz gegen die virale Replikation, die verhindert, dass zielgerichtete Therapeutika ihre normale Anti-Tumor-Wirkung entfalten können. Um dies zu bekämpfen, können gezielte Therapien, die die JAK/STAT-Signalübertragung durch IFN hemmen, eine Möglichkeit zur Überwindung der Arzneimittelresistenz sein.
Zur Unterstützung Ihrer Forschung im Bereich der IFN-Proteinfamilie bietet ACROBiosystems einen umfassenden Katalog hochwertiger IFNs an, die Ihren Anforderungen in der Arzneimittelforschung, Funktionsbewertung und Qualitätskontrolle entsprechen.
![]() HEK293 exprimiert, ursprüngliche Proteinkonformation
HEK293 exprimiert, ursprüngliche Proteinkonformation
![]() Hohe Reinheit, bestätigt durch SDS-PAGE
Hohe Reinheit, bestätigt durch SDS-PAGE
![]() Hohe strukturelle Homogenität, bestätigt durch SEC-MALS
Hohe strukturelle Homogenität, bestätigt durch SEC-MALS
![]() Hohe Bioaktivität, bestätigt durch ELISA/SPR/BLI – Verfahrensanweisung verfügbar
Hohe Bioaktivität, bestätigt durch ELISA/SPR/BLI – Verfahrensanweisung verfügbar
![]() Hohe Konsistenz von Charge zu Charge
Hohe Konsistenz von Charge zu Charge
| Molecule | Cat. No. | Species | Product Description | Preorder/Order |
|---|
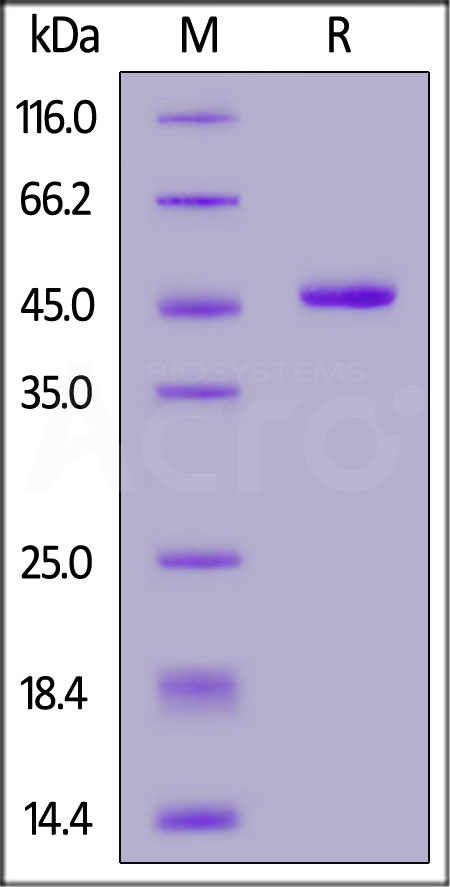
Human IFN-alpha 1 (Cat. No. IFA-H5258), Fc Tag on SDS-PAGE under reducing (R) condition. The gel was stained overnight with Coomassie Blue. The purity of the protein is greater than 95%.
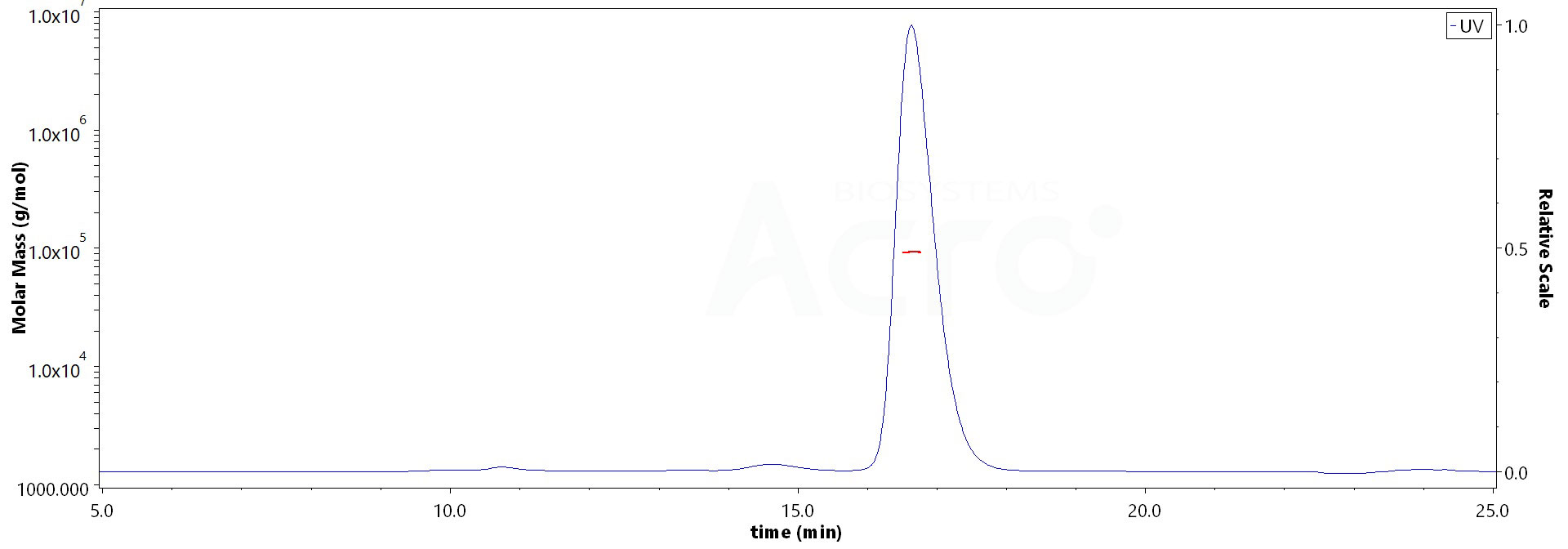
The purity of Human IFN-alpha 1, Fc Tag (Cat. No. IFA-H5258) is more than 90% and the molecular weight of this protein is around 90-118 kDa verified by SEC-MALS.
This web search service is supported by Google Inc.
